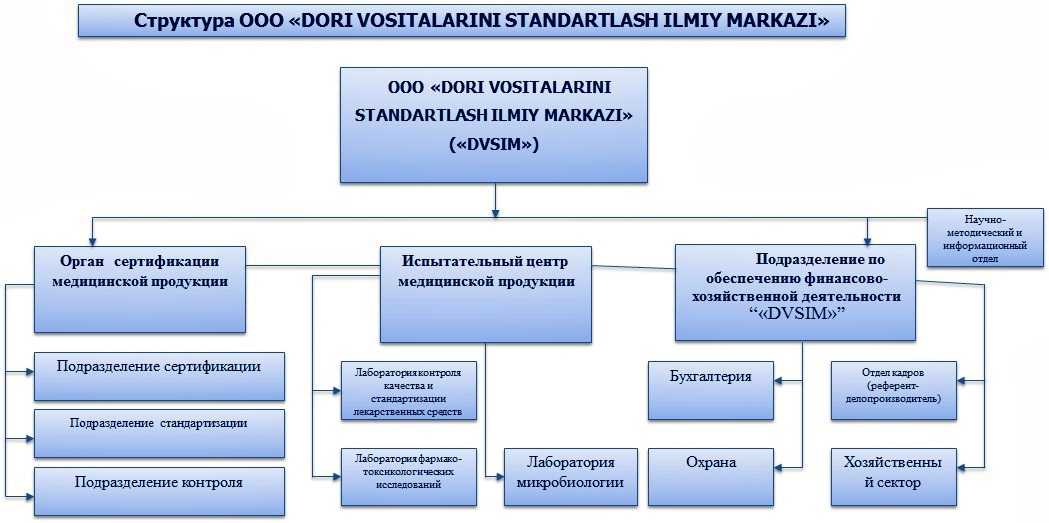
Научный центр стандартизации лекарственных средств
Xamdamov Mirzabotir Mirzaxaydarovich
Ученая степень и звание:
Должность:
Руководитель центра
Время приема:
Каждый день (9:30-12:30)
Тел.:
(+99899) 898-49-92
Э-почта:
Веб-сайт:
Услуги Научного центра стандартизации лекарственных средств
– разработка проектов НТД на новые лекарственные средства;
– подготовка пакета документов для регистрации лекарственного средства в МЗ РУз;
– апробация методов контроля качества лекарственных препаратов;
– разработка технологии получения лекарственных препаратов и пищевых добавок;
– разработка новых и усовершенствование существующих методом контроля качества лекарственных препаратов;
– доклинические фармако-токсикологические исследования новых лекарственных средств;
– биофармацевтические исследования (фармакокинетика и фармакодинамика);
– сертификация лекарственных средств и изделий медицинского назначения;
– квалифицированные услуги и консультации по оформлению заявок на товарные знаки, изобретения и промышленные образцы в области фармацевтики и медицины;
– разработка стандартных образцов лекарственных веществ;
– научно-методические и патентно-информационные услуги;
– курсы повышения квалификации для химиков аналитиков с использованием современных методов анализа (ВЭЖХ, ГЖХ и др.);
– анализ биологически активных добавок и продуктов лечебного питания;
– контроль качества лекарственных средств;
– разработка дизайна упаковок медикаментов и перевод текстов упаковок и инструкций.
Порядок проведения сертификации лекарственных средств
ЛС подлежат реализации на территории Республики Узбекистан при наличии сертификата соответствия, выданного на имя заявителя, в рамках НСС РУз, ОСМП на ЛС, аккредитованными в установленном порядке.
Сертификат соответствия на партию ЛС выдается на срок равный сроку годности ЛС, установленного нормативными документами .
Сертификация ЛС включает следующие основные операции:
а) подачу заявки на сертификацию;
б) принятие решения по заявке, в том числе, выбор схемы сертификации;
в) идентификацию, отбор образцов и доставка их в лабораторию;
г) cоставление программы испытаний
д) испытания образцов в аккредитованной лаборатории (в ИЦ либо по субподряду);
е) оценку состояния производства продукции ОСМП (для схем сертификации 3 и 4);
ж) оценку продукции поставщиком, заявка на сертификацию на основе декларации;
з) Анализ полученных результатов и принятие решения о выдачи сертификата соответствия; (положительный результат анализа является основанием выдачи сертификата соответствия)
и) Выдачу сертификата соответствия и права на применение Знака подтверждения соответствия (в соответствии с Законом Республики Узбекистан «О сертификации продукции и услуг»;
к) Осуществление инспекционного контроля за стабильностью сертифицированных характеристик продукции и стабильностью производства (в зависимости от схемы сертификации);
л) Информирование о результатах сертификации, путем регистрации сертификатов в Государственном Реестре НСС Уз и опубликования результатов сертификации.
При сертификации партии продукции должны быть предоставлены следующие документы:
а) Товаросопроводительные документы, с отметкой о прибытии ЛС на таможенную территорию РУз (товарно-транспортная накладная, счет-фактура или инвойс);
б) Данные о маркировке в соответствии с законодательством; (образец маркировки продукции приводятся в утверждённых НД на продукцию ).
в) Сведения о регистрации ЛС в Государственном Реестре лекарственных средств и изделий медицинского назначения МЗ РУз; (при необходимости).
г) копия НД на заявленную продукцию (при необходимости).
д) Документ подтверждающий качества продукции (сертификат качества, паспорта).
.